Цель: Изучение физических и
химических свойств карбоновых кислот на практике.
Вопросы входного контроля:
1. Какие вещества называют карбоновыми кислотами?
Приведите примеры. Какую функциональную группу называют карбоксильной?
2. Какой процесс называют электролитической
диссоциацией? Напишите уравнение электролитической диссоциации муравьиной
кислоты.
3. Напишите молекулярное и сокращенное ионное
уравнения реакции уксусной кислоты с карбонатом натрия. Напишите уравнение
реакции гидролиза полученной соли. Какую реакцию среды имеет ее водный раствор?
4. Какие признаки верно отражают физические свойства
уксусной кислоты: а) при комнатной температуре бесцветная жидкость; б)
газообразное вещество; в) без запаха; г) с характерным запахом; д) плохо
растворима в воде; е) неограниченно растворима в воде; ж) слабый электролит; з)
сильный электролит?
Общие сведения: Карбоновые
кислоты и их производные являются одними из самых распространенных в природе,
быту и промышленности органических соединений. Ежедневно мы сталкиваемся с
самими карбоновыми кислотами и их производными: мылами, жирами, сложными
эфирами. Функциональной группой карбоновых кислот является карбоксильная
группа. Атом углерода карбоксильной группы находится в состоянии sp2- гибридизации. Общие свойства карбоновых кислот аналогичны свойствам
слабых неорганических кислот. Карбоновые кислоты взаимодействуют с активными
металлами, с основными и амфотерными оксидами, основаниями, солями более слабых
кислот. Кроме того, карбоновые кислоты обладают рядом специфических свойств:
образование многочисленных производных и реакции по углеводородному радикалу.
Реактивы и оборудование: ацетат натрия, концентрированная серная кислота, стружки магния и гранулы
цинка, гидроксид натрия, индикатор фенолфталеин, этанол, изоамиловый спирт,
аммиачный раствор оксида серебра, муравьиная кислота, уксусная кислота;
спиртовка (электроплитка), пробирки, колбы плоскодонные, пробка с газоотводной
трубкой, трубки – холодильники.
Порядок выполнения работы:
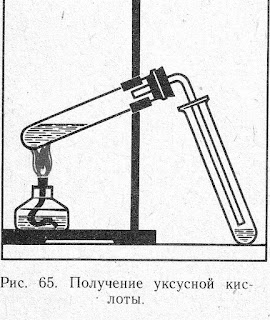
Опыт 1. Получение уксусной кислоты.
Поместите в пробирку 2-3 г ацетата натрия и прибавьте
1,5-2 мл концентрированной серной кислоты. Пробирку закройте пробкой с
газоотводной трубкой, конец которой опустите в другую пробирку (см. рисунок).
Смесь нагревайте на пламени до тех нор, пока в пробирке-приемнике соберется
1,0-1,5 мл жидкости.
Опыт 2. Взаимодействие уксусной кислоты с некоторыми металлами.
В две пробирки налейте по 1 мл раствора уксусной
кислоты. В одну пробирку всыпьте немного стружек магния, а во вторую —
несколько гранул цинка. В первой пробирке происходит бурная реакция, а во
второй — реакция протекает спокойно (иногда она начинается только при
нагревании).
Опыт 3. Взаимодействие уксусной кислоты с основаниями.
Влейте в пробирку 1-1,5 мл раствора гидроксида натрия
и добавьте несколько капель раствора фенолфталеина. При добавлении уксусной
кислоты происходит обесцвечивание.
Опыт 4. Взаимодействие уксусной кислоты со спиртами.
В две пробирки влейте по 2 мл раствора уксусной
кислоты. В одну из них прилейте 2 мл этанола, а в другую — 2 мл изоамилового
спирта. Затем в обе пробирки осторожно добавьте по 1 мл концентрированной
серной кислоты. Пробирки закройте пробками с длинными стеклянными трубками -
холодильниками. Смесь осторожно подогрейте. Жидкости из каждой пробирки налейте
в два сосуда с насыщенным раствором хлорида натрия.
Опыт 5. Окисление муравьиной кислоты оксидом серебра (I).
В чистую пробирку влейте 2 мл
свежеприготовленного раствора,
содержащего в массовых долях 0,02 или 2% нитрата серебра (I), добавьте немного разбавленного
раствора аммиака до растворения
появившегося осадка. Затем добавьте
несколько капель муравьиной кислоты и пробирку со смесью нагрейте в колбе с
горячей водой.
Вопросы итогового контроля:
1. Какое вещество образовалось в пробирке-приемнике?
Какие признаки это подтверждают?
Составьте уравнение соответствующей реакции.
2. Как
уксусная кислота реагирует с магнием и цинком? Сравните скорость этих реакций и
напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
3. Какие свойства уксусной кислоты сходны со
свойствами минеральных кислот?
4. Какие вещества образуются при
взаимодействии уксусной кислоты с основаниями? При помощи каких опытов это
можно доказать?
5. Почему для
муравьиной кислоты характерна реакция «серебряного зеркала», а другие
карбоновые кислоты не обладают таким свойством? Напишите уравнение
соответствующей реакции.
6. Зная, что хлор более электроотрицателен, чем углерод, расположите
следующие кислоты: уксусную, пропионовую, хлоруксусную, дихлоруксусную,
трихлоруксусную кислоты в порядке усиления кислотных свойств. Обоснуйте свой
ответ.
По окончании работы сформулируйте Вывод, основываясь на результатах проделанных опытов. Оформите
отчет о проделанной работе.
Комментариев нет:
Отправить комментарий